Невидимая ось: Как наш кишечник разговаривает с нашим мозгом
Чуете нутром? То у вас порхают в животе бабочки, то некто сосет под ложечкой от страха, то развивается медвежья болезнь при сильной тревоге. Знакомо? Сегодня мы поговорим о связи мозга и кишечника. Да-да, в кишечнике есть много нервных клеток, много бактерий, которые влияют на наш мозг намного сильнее, чем мы с вами думаем. Средний человек имеет около 1,5 килограммов бактерий кишечника.
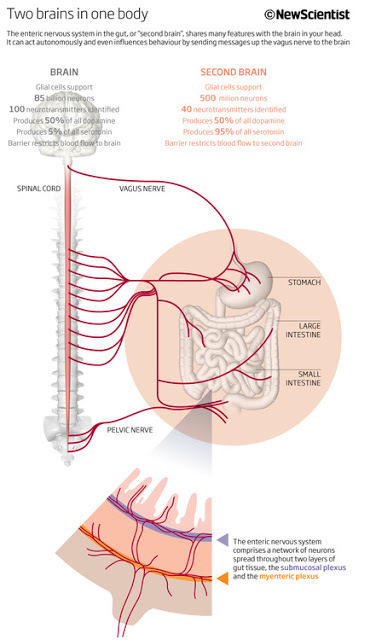
А так называемая кишечная нервная система, располагающаяся между пищеводом и кишечником, состоит из 100 млн нервных клеток. Обратите внимание: в ней их больше, чем в спинном мозге. Это второе по сложности скопление нервов в организме человека после головного мозга. Наш мозг со всеми его чувствами, эмоциями и мыслями постоянно общается с «кишеченым мозгом». Этот процесс коммуникации получил название «ось мозг – кишечник». Помните, что здоровое питание – это половина здоровья. И здоровое питание обязательно включает влияние продуктов на наших маленьких кишечных друзей. Помните, что пища - это не только калории и энергия. Пища содержит информацию, которую она сообщает вашим генам, включая и выключая их, ежемоментно воздействуя на их функции. Пища - это наиболее мощное и быстродействующее лекарство, которое вы можете принять, чтобы изменить свою жизнь. Еда это не только калории. Это информация. Она сообщает генам, что им делать (и не делать).
Что такое ось кишечник-мозг?
Ось “кишечник-мозг” – воображаемая связная линия и один из новых горизонтов комплекса нейронаук. Микробиота кишечника (иначе, микрофлора), которую часто теперь называют “вторым геномом” и “вторым мозгом”, может влиять на наше настроение посредством механизмов, которые ученые только начинают понимать. И, в отличие от генов, которые мы наследуем, микрофлору можно изменить и даже вырастить. По мере того, как исследования переходят с мышей не людей, мы получаем все больше понимания связей микрофлоры с нашим мозгом, становятся видны важные связи с ментальным (или душевным) здоровьем. Одного японского магната однажды спросили, как он узнает, стоит ли ему вступать в сделку, и он ответил: "Я проглатываю это, и, если мне нравится ощущения в моем животе, я вступаю в сделку". Наш кишечник сам себе голова, но при этом непрерывно разговаривает с нашим мозгом.
Пищеварение — сложный процесс, поэтому нет ничего удивительного в том, что для его регуляции существует отдельная нейронная сеть. Пищеварительная нервная система отвечает за процессы механического перемешивания пищи в желудке, координирует сокращение круговой мускулатуры и всех сфинктеров на протяжении кишечника для того чтобы обеспечивать поступательное продвижение пищи, она также поддерживает разную биохимическую среду и уровень кислотности внутри каждой отдельной секции пищеварительного тракта, обеспечивая ферментам необходимые условия для их работы.
Не обязательно быть гастроэнтерологом, чтоб осознавать эти реакции, или быть может более тонкие ощущения в животе, которые сопровождают эмоции, такие как тревога, волнение, или страх в период стресса. На протяжении тысячелетий люди были убеждены, что желудочно-кишечный тракт связан с мозгом и оказывает влияние на здоровье. Только в последнее столетие эта связь была подробно изучена. Двумя пионерами в этой области были американский врач Б. Робинсон (опубликовал в 1907 году свой труд под названием «The Abdominal and Pelvic Brain») и его современник британский физиолог И. Лэнгли, который придумал термин «желудочно-кишечная нервная система».
В начале ХХ века англичанин Ньюпорт Лэнгли подсчитал количество нервных клеток в желудке и кишечнике — 100 миллионов. Больше, чем в спинном мозге! Здесь нет полушарий, но в наличии разветвленная сеть нейронов и вспомогательных клеток, где гуляют всяческие импульсы и сигналы. Возникло предположение: нельзя ли считать такое скопление нервных клеток своеобразным «брюшным» мозгом?
Кишечный мозг
На сей счет высказался профессор нейрогастроэнтерологии Пауль Энк из Тюбингенского университета: «Мозг живота устроен примерно так же, как головной. Его можно изобразить в виде чулка, охватывающего пищевод, желудок и кишечник. В желудке и кишечнике людей, страдающих болезнями Альцгеймера и Паркинсона, обнаружены те же повреждения тканей, что и в головном мозге. Поэтому антидепрессанты вроде прозака так действуют на желудок».
Спустя десятилетие после выхода в свет популярнейшего произведения "Второй мозг" американский ученый подтверждает предположение, что нервная система кишечника - это не тупое скопление узлов и тканей, выполняющих команды центральной нервной системы, как гласит старая медицинская доктрина, а уникальная сеть, способная осуществлять сложные процессы самостоятельно.
Примечательно, что кишечник продолжает функционировать, даже когда отсутствует связь с головным и спинным мозгом. Кишечный мозг самостоятельно решает все аспекты пищеварения на всем протяжении желудочно-кишечного тракта - от пищевода до кишечника и прямой кишки. При этом им используются те же инструменты, что и "благородным" мозгом: целой паутиной нейронных цепочек, нейропередатчиков и протеинов. Эволюция свидетельствует о своей проницательности: вместо того, чтобы заставлять голову жестоко напрягаться работой миллионов нервных клеток для связи с удаленным участком организма, она предпочла передоверить управление центру, расположенному в контролируемых им зонах.
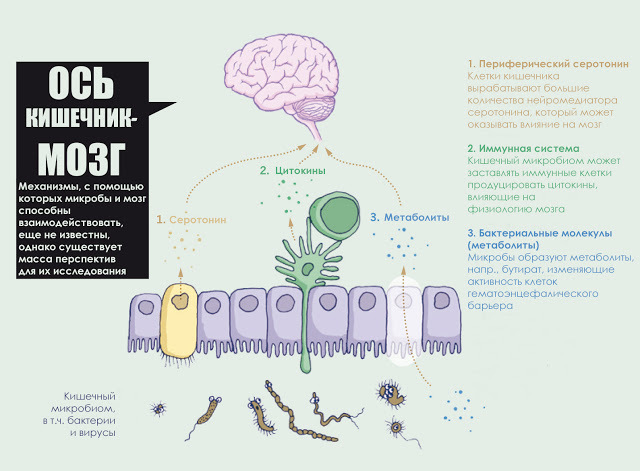
Согласно современным представлениям, нейромедиаторы, вырабатываемые нейронами желудочно-кишечного тракта, не способны попасть в головной мозг, однако теоретически они, все-таки могут проникнуть в небольшие области мозга, где уровень проницаемости гематоэнцефалического барьера выше, например, в гипоталамус. Как бы там ни было, нервные сигналы, посылаемые из желудочно-кишечного тракта в головной мозг, бесспорно, затрагивают настроение. Исследователи начали расшифровывать способы, которыми бактерии кишечника могут подавать сигналы мозгу. Петерсон и другие показали, что у взрослых мышей микробные метаболиты влияют на основную физиологию гематоэнцефалического барьера. Кишечные микробы расщепляют сложные углеводы до короткоцепочечных жирных кислот с образованием массы эффектов: бутираты жирных кислот, например, укрепляют гематоэнцефалический барьер, “затягивая” соединения между клетками.
Сосуществование симбионтной микрофлоры и ее носителя, по большей части, взаимовыгодно. В частности, присутствие симбионтов принципиально для функционирования нашей иммунной системы, переработки питательных веществ и для других аспектов здоровой физиологии. Используя самые современные инструменты для изучения генетики и тканей организма на молекулярном уровне, ученые смогли продемонстрировать, что в кишечнике представлены несколько типов бактерий, и что симбионтные популяции характеризуются большим разнообразием: можно выделить до тысячи разных видов. В дополнение к этому, на формирование индивидуальной микрофлоры постоянно влияют такие факторы как пол, генетика, возраст, тип питания .
У здоровых людей бактериологическое разнообразие существенно больше, но при этом, изучая микрофлору таких людей в разные моменты времени (с промежутком в несколько месяцев, можно увидеть, что состав едва ли меняется. А вот в стрессовых ситуациях или в ответ на физиологические или диетические изменения, микрофлора может сама измениться, создавая дисбаланс во взаимодействии между микрофлорой и ее носителем. И такие изменения могут влиять на состояние здоровья человека.
Влияние на состояние здоровья
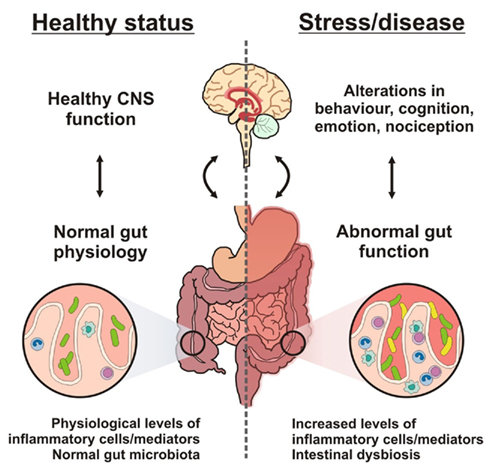
Взаимонаправленные связи между кишечником и мозгом осуществляются посредством эндокринной, нервной, иммунной систем и неспецифического природного иммунитета. Кишечная микрофлора как активный участник кишечно-мозговой оси не только оказывает влияние на кишечные функции, но также стимулирует развитие ЦНС в перинатальном периоде и взаимодействует с высшими нервными центрами, вызывая депрессию и когнитивные расстройства при патологии. Особая роль принадлежит микроглии кишечника. Помимо механической (защитной) и трофической функции для кишечных нейронов, глия осуществляет нейротрансмиттерную, иммунологическую, барьерную и моторную функции в кишечнике. Существует взаимосвязь между барьерной функцией кишечника и регуляцией гематоэнцефалического барьера.
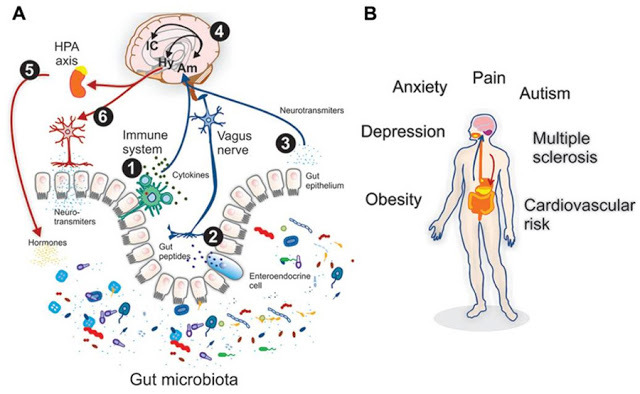
Хроническая эндотоксинемия (высокий уровень токсинов в крови) как результат дисфункции кишечного барьера формирует устойчивое воспалительное состояние в околожелудочковых зонах мозга с последующей дестабилизацией гемато-энцефалического барьера и распространением воспаления на другие участки мозга, следствием чего является развитие нейродегенерации.
Установлено, что микробиота, оказывающая действие на барьерную функцию слизистой оболочки и вызывающая иммунный и нейроэндокринный ответ, может давать прямые и непрямые эффекты на функцию и даже морфологию мышечных и нервных клеток кишечника. Исследования показали наличие взаимосвязей между воспалением слизистой оболочки и моторной и сенсорной функциями кишки, нарушение ее барьерной функции при модификации микробиоты и последствия изменений целостности слизистой оболочки для хозяина. Иммунный ответ, индуцированный микроорганизмами, привлекает к себе повышенное внимание исследователей, учитывая возможный вклад воспаления в патогенез моторной дисфункции при различных заболеваниях.
Депрессия и микрофлора
Например, сегодня уже известно, что в депрессии есть воспалительный компонент и многие полезные бактерии в кишечнике вырабатывают короткоцепочечные жирные кислоты, такие как бутират, способствующие питанию клеток, выстилающих кишечник, чтобы уменьшить воспаление. Микробиом связали с депрессией совсем недавно, когда было обнаружено, что бактерии Oscillibacter вырабатывают химическое вещество, действующее как естественный транквилизатор, имитирующий действие нейромедиатора ГАМК (этот нейродиметиатор — гамма-аминомасляная кислота — понижает нервную активность мозга и может привести к депрессии). Способность почвенных микробов, например микобактерии вакка (Mycobacterium vaccae), модулировать иммунную систему человека давно известна, и некоторые исследователи даже предполагают, что это свойство можно использовать для создания вакцины против стресса и депрессии.
В частности, Грэм Рук из Университетского колледжа Лондона утверждает, что недостаточный контакт с нашими старыми друзьями — почвенными микробами, воздействию которых мы подвергались на протяжении всей истории, но теперь, в своем неумеренном стремлении к чистоте, свели к нулю, — это причина распространения многих заболеваний, в том числе диабета, артрита и депрессии.
Анорексия и микрофлора
Исследователи из Медицинской школы Университета Северной Каролины (University of North Carolina School of Medicine) считают, что этот бактериальный дисбаланс может быть связан с некоторыми психологическими симптомами, встречающимися при этом заболевании, которое, как известно, имеет самый высокий показатель смертности, чем любое другое нарушение психического здоровья. Известно, что микробное разнообразие – это признак хорошего общего здоровья. Предыдущие исследования также позволяют предполагать, что обилие и разнообразие микрофлоры кишечника может повлиять и на так называемую «ось кишечник-мозг». По мере того, как у пациенток с анорексией улучшался кишечный микробиом, увеличивался и вес, а также улучшалось и настроение пациенток, что предполагает наличие связи между этими факторами.
Тревога, воспаление и микрофлора
Поскольку кишечная микрофлора играет ключевую роль в развитии иммунитета, можно считать, что у стерильных мышей воспалительные процессы всегда тихие. Когда мы рассматриваем связь между воспалением и тревожным поведением, мы можем наблюдать, что низкая тревожность обнаруживается там же, где и воспалительные процессы не выражены сильно, а вот более сильное воспаление ведет к повышению тревожности.
Например, инфицирование мышей паразитом Trichuris muris ведет к воспалению в кишечнике и возрастанию уровня тревожности. В дополнение к этому, химически спровоцированное воспаление (колит) также приводит к повышению тревожности. В тех же исследованиях предоставляются и доказательства в пользу того, что микрофлора выступает в роли модулятора этой тревожности в поведении, связываемой с иммунной реакцией: в отчетах говорится, что “лечение” пробиотической культурой Bifidobacterium longum уменьшало эту тревожность. Эти наблюдения предполагают, что назначение пробиотиков может оказаться перспективным при лечении воспалительных процессов или связанных с ними симптомами “тревожности”.
Группа из Мак-Мастерского университета стал искать ответы, исследуя мышей. В исследовании 2011 года команда пересаживала образцы микрофлоры кишечника между различными штаммами мышей и показала, что поведенческие черты, характерные для определенного штамма, передаются вместе с ней. Берчик рассказывает, например, что «относительно застенчивые» мыши будет демонстрировать более “исследовательское” поведение при пересадке им микробиоты стремящихся к приключениям мышей. «Мне кажется, это удивительно. Микробиота действительно определяет фенотип поведения хозяина. Разница очевидна,» говорит Берчик. Неопубликованные исследования показывают, что выделенные от человека как с СРК и тревожностью фекальные бактерии при пересадке мышам вызывает беспокойное поведение и у них, в то время как пересадка бактерий здоровых людей такого эффекта не дает.
Стресс и микрофлора
Одно из первых исследований, рассматривающих связь стресса и микрофлоры показало, что у стерильных мышей стрессовая реакция излишне интенсивная. А другое, более свежее исследование показало, что подверженность стрессу крыс “в юности” вызывает нарушения в составе микрофлоры и ведет к более интенсивным стрессовым реакциям в зрелости. Важно, что в этом исследовании обнаружили: если крысятам давать пробиотик (бактерии Lactobacillus sp) это нормализует уровень гормонов стресса. Стресс на ранних этапах жизни ведет к более депрессивному поведению у зрелых крыс. Другое похожее исследование показало, что если крысиному молодняку, подверженному стрессу, давать пробиотики (бактерии Bifiodo infantis), то уменьшаются признаки депрессии в зрелости.
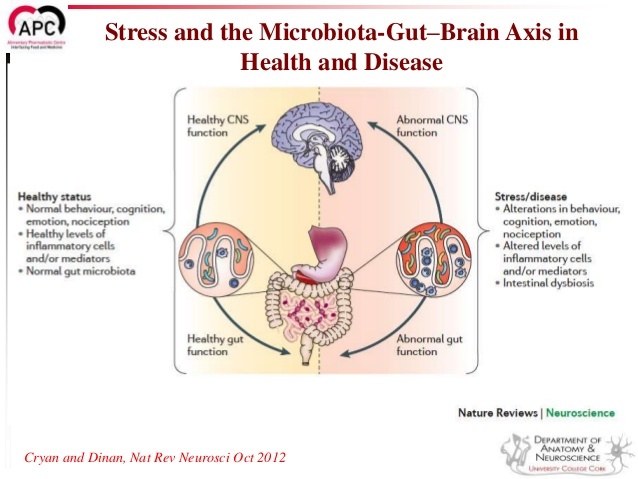
Вместе эти исследования наводят на вывод о том, что нужно признать связь между дисбалансом микрофлоры (дисбактериозом), изменениями в поведении в связи с влиянием стресса и стрессовой реакцией. Также напрашивается вывод, что использование пробиотиков может быть эффективно в лечении симптомов, связанных со стрессом.
В ходе небольшого исследования, участниками которого стали молодые здоровые мужчины, ученые из Университетского колледжа Корка (University College Cork), Ирландия, выявили, что прием пробиотических препаратов, содержащих штамм Bifidobacterium longum (B. longum), способствует снижению уровня физиологического и психологического стресса и улучшает состояние памяти. Доклад об этой работе представил руководитель исследования доктор Джерард Кларк (Gerard Clarke) на ежегодном собрании Сообщества нейронауки (Society for Neuroscience — SfN). Он отметил, что основой для ее проведения стали доклинические эксперименты, в ходе которых стало известно, что штамм B. longum оказывает позитивное воздействие на когнитивные функции лабораторных мышей и уменьшает выраженность физиологических и поведенческих проявлений стресса.
В данной работе приняли участие 22 волонтера (мужчины, средний возраст — 25,5 года), которые в течение 4 нед принимали препарат, содержащий штамм B. longum NCIMB 41676, а затем следующие 4 нед — плацебо. В начале работы и по окончании каждого 4-недельного периода ученые оценивали уровень острого стресса у частников, используя холодовой прессорный тест и измеряя уровень кортизола — гормона стресса, а ежедневного — с помощью Шкалы воспринимаемого стресса Коэна (Cohen Perceived Stress). Состояние когнитивных функций у волонтеров определяли, исходя из показателей неврологической активности и результатов нейропсихологических тестов.
Проанализировав полученные результаты, авторы исследования отметили, что прием препарата, содержащего пробиотический штамм B. longum NCIMB 41676, приводил к снижению уровня кортизола и субъективному уменьшению уровня тревожности. Участники констатировали, что во время приема препарата они чувствовали себя менее напряженными, чем в начале исследования, а их зрительная память значительно улучшилась.
Исследователи подчеркнули, что новая концепция, рассматривающая микрофлору кишечника как ключевой регулятор поведения и функционирования головного мозга, представляет собой смену парадигмы в нейронауке. Точечное медикаментозное вмешательство в ось «микробиота — кишечник — мозг» с помощью психобиотиков — микроорганизмов с потенциально положительным влиянием на психическое здоровье — может рассматриваться как новый подход к лечению патологических состояний, ассоциированных со стрессом. Они полагают, что целью дальнейших работ должно стать изучение механизмов, лежащих в основе выявленной взаимосвязи.
Заключение
Кишечная микрофлора (микробиота) – огромная популяция, важная для здорового обмена веществ и функционирования головного мозга, а коммуникация между кишечником и мозгом проходит в т.ч. через нейронные связи. Кишечная микрофлора очень важна в раннем возрасте и может оказывать влияние на то, какие реакции на стресс будут вырабатываться в мозгу
Пробиотики (исследования на людях и животных показали что пробиотики или, иначе говоря, “хорошие бактерии”, оказывают положительное воздействие на настроение. И хотя это очень многообещающие открытия, не нужно спешить и думать, что мы уже нашли решение для клинических ситуаций (расстройств поведения и настроения). Конечно, микрофлора является важным модулятором здоровья и ее следует считать составляющей сложной, многогранной системы коммуникации, которая необходима для установления здорового баланса для развития и здоровой работы мозга.
Но! Критерием здоровья кишечника является не только некий один пробиотик, а именно разнообразие микрофлоры.Поэтому важна нормализация питания в целом! Увы, уникального пробиотика не существует. Что делать для улучшения микрофлоры, напишу потом. опубликовано econet.ru
P.S. И помните, всего лишь изменяя свое потребление - мы вместе изменяем мир! © econet
Источник: https://econet.kz/
Понравилась статья? Напишите свое мнение в комментариях.Подпишитесь на наш ФБ: , чтобы видеть ЛУЧШИЕ материалы у себя в ленте!

Добавить комментарий